Les Hantaviroses

L'hantavirose ou infection à hantavirus est une infection virale transmise à l'homme par l'intermédiaire de différentes espèces de rongeurs. Les hantavirus sont des virus responsables de fièvres hémorragiques avec syndrome rénal (FHSR), infections initialement identifiées comme « fièvre des tranchées » ( des cas ’’néphrite azotémique pure’’ sont rapportés lors de la 1ère guerre mondiale et une épidémie s’est déclarée en Laponie en 1942 parmi les troupes allemande et finlandaise ) ou « fièvre de Corée » ( à cause de l’épidémie qui avait touché les Marines US durant la guerre de Corée en 1951 ) , d’une forme relativement bénigne appelée "néphropathie épidémique" (N.E.) et également de syndrome cardio-pulmonaire aigu(HPS) en particulier sur le continent américain.
Depuis la mise en évidence en 1976 par H. Lee d’un antigène spécifique du virus Hantaan dans les poumons d’un rongeur (mulot) responsable de la fièvre hémorragique de Corée, de nombreuses autres souches ont été mises en évidence. Ces hantavirus sont des virus enveloppés d'un diamètre de 90-120 nm possédant un génome composé de trois segments d'ARN simple brin de sens négatif. Les segments d'ARN sont empaquetés dans une capside composée d'une protéine N très antigénique, la capside étant elle-même entourée d'une enveloppe lipidique contenant des spicules composés des protéines G1 et G2. Ils sont classés en huit sérotypes/génotypes qui forment le genre Hantavirus dans la famille des Bunyaviridae.
Sur le plan phylogénétique, on distingue trois grands groupes, les uns sont transmis par les Murinae (sérotype Hantaan, Séoul et Dobrava), les autres par les Sigmodontinae (virus du continent américain) et les troisièmes par les Arvicolinae (sérotype Puumala et Tula). Le virus Séoul, cosmopolite, est à l’origine de cas humains en Asie, en Europe en dans différentes autres régions du monde en rapport avec son réservoir représenté par le rat (Rattus rattus et Rattus norvegicus). Le virus Hantaanqui a été isolé en premier, est responsable de centaines de cas par an de FHSR en Asie, avec une létalité avoisinant les 5%. Le virus Dobrava isolé en Slovénie en 1992 est responsable de cas sévères avec une létalité de 1-2 %. En Europe et même au Japon circule principalement le virus Puumala (Puu) dont le réservoir est le campagnol roussâtre et le campagnol à flancs gris ; il est responsable de la néphropathie épidémique (NE) forme beaucoup moins grave que la fièvre hémorragique de Corée. Sur le continent américain , ce sont les virus Sin Nombre et Andes qui sont retrouvés. Les réservoirs de ces virus sont des rongeurs de la famille des Sigmodontinae. Ils sont responsables de syndrome cardio-pulmonaire aigu (HPS) dont la létalité est proche de 30 % voire même 50 %.
La transmission se fait principalement par la voie respiratoire, par inhalation de particules virales provenant de l'urine, de la salive ou des excréments des rongeurs infectés. On peut également être infecté en se touchant la bouche ou le nez après avoir été en contact avec des matières contaminées ou après une morsure de rongeur. . Il n'y a pas de risque d'attraper la maladie lors d'un contact avec une personne qui a une hantavirose. Les personnes qui ont déjà fait une hantavirose ne risquent pas de refaire la maladie car elles conservent dans le sang des anticorps qui les protègent contre une nouvelle infection par le virus.
Les cas d'hantavirose apparaissent lorsque la population locale de rongeurs est abondante et/ou fortement infectée par le virus.
Les Hantavirus et leur réservoir

D’après : M. Bouloy & H. Zeller. 3ème colloque du réseau international des Instituts Pasteur
Paris, 14-15 octobre 1999
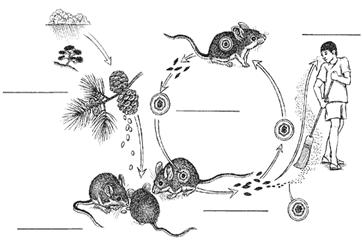
Mode de contamination par l’hantavirus
Clinique
Les hantavirus, responsables de la fièvre hémorragique avec syndrome rénal (FHSR) et de pneumonies, sont très répandus dans le monde. Près de 200 000 personnes présentent une FHSR chaque année, principalement en Eurasie. En Europe, la forme la plus fréquente est la "néphropathie épidémique" (N.E.); elle se présente sous une forme relativement bénigne par rapport aux autres formes d'hantavirose.
Le Hantaan virus est responsable d’une forme sévère de la maladie, hémorragique, mortelle dans 5 à 10%, présente particulièrement en Extrême–Orient. Une forme moins grave du FHSR est provoquée par le virus Séoul dont le réservoir est le rat que l'on trouve habituellement dans les villes et les ports. Le virus Puumala est l'agent causal d'une forme bénigne du FHSR, la néphrite épidémique (NE), que l'on retrouve dans presque toute l'Europe. En Finlande, près de 1000 cas de NE sont rapportés chaque année. En France, l'hantavirose a été confirmée sérologiquement pour la 1ère fois en 1982. En 2000, une petite flambée de syndrome pulmonaire de type hantavirus a été mise en évidence au Panama à la suite d’inondations qui ont contribué à l'accroissement des populations de rongeurs. Une épidémie de FHSR a sévit en Finlande en 2005 et des sérologies positives ont été retrouvées à Madagascar. En Algérie, l’hantavirose inconnue jusque là, a fait son apparition à Sidi Bel Abbès au cours de l’été 2007 où près d’une centaine de cas ont été diagnostiqués (voir :www.santemaghreb.com/algerie ). Le réservoir étant probablement le rat, c’est le sérotype Séoul qui nous semble être responsable de cette épidémie dans notre pays.
La période d'incubation de la maladie est en moyenne de 2 à 4 semaines, mais peut varier de une semaine à deux mois. Le tableau clinique de la néphropathie épidémique évoque un syndrome grippal avec début brutal, courbatures, frissons, sueurs, asthénie et fièvre élevée; un syndrome algique suit habituellement après quelques jours, il est variable dans ses localisations (céphalées, lombalgies, douleurs abdominales, thoraciques,...).Du point de vue biologique, on note très souvent une thrombopénie et une atteinte rénale (protéinurie, élévation de la créatinémie). L'évolution est toujours favorable. La forme décrite en Europe de l’ouest, due au virus Pumalaa et transmise par le campagnol, prédomine dans le sexe masculin alors que dans le cas de l’épidémie de Sidi Bel Abbes, 70 % des cas sont des femmes.
Les symptômes, qui apparaissent en général de façon brutale de 1 à 4 semaines après la contamination, peuvent être les suivants :
- fièvre pouvant atteindre 40°C ou frissons (syndrome grippal),
- maux de tête,
- douleurs musculaires ou dorsales.
Le tableau n’est pas toujours typique, le syndrome algique peut être prédominant et faire évoquer une colique néphrétique, une urgence abdominale ou cardiaque.
Les signes hémorragiques sont peu fréquents, et habituellement discrets (pétéchies, hématurie macroscopique, …).
Des manifestations respiratoires (épanchement pleural uni ou bilatéral ,atélectasies et infiltrats sont corrélées avec la sévérité de l’insuffisance rénale aiguë, ) , cardiaques (bradycardie ou absence de tachycardie lors des épisodes fébriles ,plus rarement myocardite et bloc auriculo-ventriculaire ) et neurologiques peuvent survenir.
L'atteinte rénale se manifeste à partir du 3ème ou 4ème jour par une oligurie, une protéinurie, une hématurie microscopique. La sévérité de l’insuffisance rénale aiguë est très variable. Sur le plan histologique, les lésions rénales correspondent à une néphrite tubulo-interstitielle aiguë. La lésion histologique rénale la plus évocatrice du diagnostic de FHSR, serait représentée par les infiltrats hémorragiques de la médullaire externe, accompagnés d’une congestion des capillaires péri tubulaires. Dans un petit pourcentage de cas un recours à l’épuration extra-rénale s’avère indispensable mais en général le pronostic est bon et la guérison se produit dans les 2 à 3 semaines qui suivent l'apparition des premiers symptômes, bien qu'un état de fatigue peut persister longtemps. Les complications à long terme sont rares.
L’atteinte pulmonaire
L’infection au hantavirus en Amérique , appelée syndrome pulmonaire dû au hantavirus (HPS) a été décrite pour la 1ère fois dans le Sud des États-Unis en 1993 dans la région dite des quatre frontières (Four Corners) puis au Canada et dans plusieurs autres pays d’Amérique Centrale et d’Amérique Latine . Cette infection est responsable d’un syndrome de détresse respiratoire aigu, létal dans 50% des cas. Ce HPS est dû aux virus Sin Nombre, Black Creek Canal virus, Bayou virus, New York virus, etc.
Diagnostic biologique
Sur le plan biologique, une thrombopénie et une protéinurie massive sont souvent retrouvées , mais le diagnostic repose sur la détection de l'ARN viral dans les échantillons sanguins, par biologie moléculaire (immunofluorescence indirecte et recherche d’anticorps par ELISA). Ce test s’il est réalisé en phase aiguë, est souvent négatif aussi un examen de confirmation est souvent nécessaire quinze jours plus tard (est ce la raison des hésitations de la cellule de crise mise en place au CHU de Sidi Bel Abbes ?). Des antigènes du virus peuvent être détectés dans le rein sur des fragments de biopsie rénale effectuée au stade d’insuffisance rénale aiguë. L'organe de prédilection pour la recherche d'ARN viral chez les rongeurs est le poumon.
Traitement
Dans la majorité des cas, il suffit de traiter la fièvre et les maux de tête, de préférence avec des antalgiques contenant seulement du paracétamol.
Parfois, les atteintes rénales et pulmonaires peuvent être importantes et le patient doit bénéficier de soins de dialyse et/ou d'assistance respiratoire.
Des vaccins sont actuellement en cours de développement, destinés surtout pour les pays où la maladie se présente sous une forme plus grave.
Un traitement supportif par la Ribavirine a également été proposé , mais le meilleur traitement reste évidemment la prévention dont les mesures sont variable d’un pays à un autre selon le rongeur réservoir du virus .
Dans le cas du virus Séoul dont le réservoir est le rat , ces mesures sont :
- Diminution de la population des rongeurs par des campagnes de dératisation, en particulier au niveau des zones habitées
- Port de masque et de gants, humidification préalable des zones à traiter pour éviter de soulever d’éventuelles gouttelettes contaminantes
- Eviter la fréquentation des locaux fermés, caves et lieux où pullulent les rongeurs
- Aération des lieux fermés et des caves
- Ne pas utiliser de piège à rat pour la dératisation des caves et en cas de présence de rats morts, ne pas les toucher à mains nues
- Déposer les rongeurs morts dans des sacs en plastique contenant suffisamment d’eau de Javel pour couvrir tout le corps des animaux
- Les cadavres de rongeurs doivent être incinérés ou enterrés en profondeur ….
Pour en savoir plus :
1. Bouloy M. & Zeller H. Les Hantavirus : données récentes et revue dela littérature. Manuscrit n° 2155/RIP3. 3e colloque du réseau international des Instituts Pasteur . 14-15 octobre 1999, Paris.
2. Bourdon F, Mougenot B, Vanhille P, et al. Fièvres hémorragiques et syndrome rénal (20 observations). Rev. Med Interne 1993; 14: 396-9.
3. Center for disease control and prevention , outbreak of acute illness – South-western United states, Morb Mortal Wkly Rep, 1993, 42, 421-424.
4. J. Clement , P. Heyman , P. Colson , PHP. Groeneveld , Spread of hantavirus infections in Europe, The Lancet, Vol, 347 - March 16,1996 - 771.
5. J. Clement , P. Colson , P. Mc Kenna, Hantavirus pulmonary syndrome in New England and Europe, The New England Journal of Medicine, Vol, 331-8, Aug, 25, 1994, 545-6,
6. J. Clement , P. Mc Kenna, P. Colson , Ph. Damoiseaux , C. Penalba , P. Halin , D. Lombart, Hantavirus epidemic in Europe, 1993, The Lancet Vol, 343 , January 8, 1994 – 114
7. P. Colson , Ph. Damoiseaux , J. Brisbois , E. Duvivier et al. Epidémie d'Hantavirose dans l'Entre-Sambre-et-Meuse - Année 92-93 Données cliniques et biologiques, Acta Clinica Belgica 50-4, 1995
8. N. Crowcroft et al. Risk factors for human hantavirus infection : the first Franco-Belgian collaborative case-control study during the 1995/1996 epidemic’. British Medical Journal vol n° (mars 1999).
9. Elliott RM - Concluding remarks and future prospects. In: The Bunyaviridae. Elliot RM (ed) in series The viruses Frankelconrat H & Wagner RR, 1996, p. 295-332.
10. Gavrilovskaya I, Shepley M, Shaw R, Ginsberg M & Mackow E – Beta 3 integrins mediate the cellular entry of Hanta -viruses that cause respiratory failure. Proc Natl Acad Sci USA, 1998, 95, 7074-7079.
11. Hedman K., Vaheri A., Brummer Korvenkontio M., Rapid Diagnosis of hantavirus disease with an IgG-avidity assay, 1991, Lancet, 338: 1353-56 .
12. Henderson WW, Monroe MC, ST Jeor SC, Thayer WP, Rowe JE et al.– Naturally occurring Sin Nombre virus genetic reassortants. Virology, 1995, 214 , 602-610.
13. Ilef D. , Infuso A., Crowcroft N.. L'infection à hantavirus dans les Ardennes belges et françaises. Enquête épidémiologique. Avril - Juillet 1996
14. Kanerva M, Mustonen J & Vaheri A –Pathogenesis of Puumala and other hantavirus infections. Rev Med Virol, 1998, 8, 67-86.
15. Khan A, Khabbaz R, Graber J, et al. Hantavirus pulmonary syndrome: The first 100 US Cases. J Inf Dis 1996 ; 173 : 1297-303.
16. A.S. Khan, T. G Ksiarek, C.J. Peters , Hantavirus pulmonary syndrome, The Lancet Vol, 347 - March 16, 1996 - 73941,
17. Launay D, Roueff S, Vanhille P, et al. Syndrome pneumorénal secondaire à une infection à Hantavirus. Nephrologie 1999; 20: 262.
18. Lee HW, Lee PW, Baek LJ & Chu YK – Geographical distribution of hemorrhagic fever with renal syndrome and Hantaviruses. Arch Virol, 1990, supplement, 15-18.
19. B. Le Guenno, D. Coudrier , M.A. Camprasse , Les Hantavirus : aspects virologiques et diagnostiques. Données sur l'épidémiologie de la fièvre hémorragique avec syndrome rénal en France, Spécial :512-6 Méd, Mal Infect, 1994 ; 24
20. B. Le Guenno , D. Coudrier , M.A. Camprasse , Epidémiologie de la fièvre hémorragique avec syndrome rénal en France, BEH n° 10/94
21. Li D, Schmaljohn AL, Anderson K & Schmaljohn CS –Complete nucleotide sequences of the M and S segments of two Hantavirusisolates from California: evidence for reassortment in Nature among viruses related to Hantavirus pulmonary syndrome. Virology, 1995,206 , 973-983.
22. Lopez N, Padula P, Rossi C, Lazaro ME & Franze-Fernadez MT – Genetic identification of a new Hantavirus causing severe pulmonary syndrome in Argentina. Virology, 1996, 220 , 223-226.
23. Lundkvist A., Niklasson B., Haemorrhagic fever with renal syndrome and other hantavirus infections. Reviews in Medical Virology, 1994, 4: 177-184
24. Mailles A, AbuSin M, Ducoffre G, Heyman P, Koch J, Zeller H. Larger than usual increase in cases of hantavirus infections in Belgium, France and Germany, June 2005. Eurosurveillance weekly 2005;10(7).
25. Mäkelä S, Hala-Houhala I, Pasternack A, et al. Renal function and blood pressure five years after Puumala virus-induced nephropathy. Kidney Int 2000; 58: 1711-8.
26. Müller R, Poch O, Delarue M, Bishop DHL & Bouloy M - Rift Valley fever virus L segment: correction of the sequence and possible functional role of newly identified regions conserved in RNA-dependent polymerases. J Gen Virol, 1994, 75, 1345-1352.
27. Nichol ST et al .- Genetic identification of a Hantavirus associated with an outbreak of acute respiratory illnesss. Science, 1993, 262,914-917.
28. Olli Vapalahti, Antii Vaheri , Heikki Henttonen .Les infections à Hantavirus en Finlande. Kansanterveys 1995; (5): 9-11.
29. Olli Vapalahti et al . Hantavirus infections in Europe, The Lancet, Infectious diseases, Vol 3 Oct. 2003.
30. C. Penalba , P. Halin , P. Lanoux , J.C. Reveil, B. Le Guenno , A.M. Camprasse , Fièvre hémorragique avec syndrome rénal (FHSR), Aspects épidémiologique et clinique dans le département des Ardennes (76 observations), Méd, Mal Infect,1994,24,Spécial : 506-11
31. C. Penalba , P. Goupil, A. Reksa , J.C.Reveil, B. Le Guenno, M.A.Camprasse , La fièvre hémorragique avec syndrome rénal dans les Ardennes étude épidémiologique du personnel de l'O.N.F. BEH n° 5/95
32. Penalba C., Galempoix JM. Fièvre aux Hantavirus. Encycl. Med. Chir., Maladies infectieuses, 8-063-B-10, 2000, 8 p.
33. Plyusnin A, Vapalahti O & Vaheri A – Hantaviruses: genome structure, expression and evolution. J Gen Virol, 1996,77, 2677-2687.
34. Rollin PE et al.– Hantavirus epidemic in Europe, 1993. Lancet,1994,343, 115-116.
35. Shutov A, Maximova E, Bruzgacheva O. Haemorragic fever with renal syndrome and chronic renal failure. Lancet 1996 ; 348 : 1594-5.
36. Sibold C et al.- Recombination in Tula Hantavirus evolution : analysis of genetic lineages from Slovakia. J Virol, 1999, 73, 667-675.
37. Vanhille P, Binaut R, Fleury D, et al. Fièvre hémorragique avec syndrome rénal. Néphrologie 2001; 22: 301-5.
38. Wells RM et al.- An unusual Hantavirus outbreak in southern Argentina: person-to-person transmission? Emerg Infect Dis,1997, 3, 171-174.
39. http://www.eurosurveillance.org/ew/2005/050721.
40. http://www.invs.sante.fr/actualite/index.htm : Recrudescence des infections à Hantavirus, Nord-Est de la France, Point InVS 9 sept. 2005 .


