Cancers solides et thrombopénies de causes aigües
Les causes aiguës (‹ 8 jours) La Coagulation intra-vasculaire disséminée (CIVD)
Il s'agit d'une des causes les plus fréquentes de thrombopénies chez les patients souffrant de cancers.
Une étude a retrouvé une CIVD chez 50 % de patients atteints de cancer et plus particulièrement chez 90 % présentant une pathologie disséminée (Sallah S et al.1)
La CIVD est la conséquence de l'activation de facteurs pro coagulants par les facteurs tissulaires présents à la surface des cellules cancéreuses. Elle associe thromboses et hémorragies du fait de la formation excessive de fibrine et de la consommation de plaquettes, prothrombine, fibrinogène, facteurs V et VIII.
La présentation est plus fréquemment thrombotique qu'hémorragique dans les cancers solides (surtout dans les adénocarcinomes). La coagulopathie de consommation est suggérée par la présence de schizocytes et de fragments d'érythrocytes sur le frottis. Le diagnostic se pose devant une augmentation du TP (temps de prothrombine), du TCK (temps de céphaline kaolin) des D-Dimères ainsi qu'une diminution du fibrinogène.
On distingue la CIVD biologique (asymptomatique), fréquente chez les patients cancéreux, clinique (manifestations hémorragiques ou ischémiques) et compliquée (pronostic vital ou fonctionnel engagé).
Il est primordial de retenir que le traitement optimal de la cause est la condition sine qua non de l'efficacité du traitement de la CIVD. La stratégie thérapeutique dépend de la prédominance du syndrome hémorragique ou thrombotique, de l'étiologie de la CIVD et de la nécessité ou non d'un acte invasif. Dans la CIVD compliquée d'une hémorragie grave, l'objectif thérapeutique est de limiter le saignement. Les moyens sont la transfusion de concentrés plaquettaires et de plasma frais congelé (PFC) jusqu'à arrêt du saignement. En cas de procédure invasive ces produits doivent être transfusés immédiatement avant la réalisation du geste. La transfusion plaquettaire n'est indiquée qu'en cas d'association d'une thrombopénie inférieure à 50 G/L et de facteurs de risque hémorragique (acte invasif, thrombopathie associée) ou d'hémorragie grave (CIVD compliquée). Le choix entre le plasma sécurisé et le plasma viro-atténué (PVA) dont l'efficacité est identique, se fait sur la disponibilité et le coût, favorables au PVA. La transfusion de PFC (10 à 15 ml/ kg) est indiquée dans les CIVD avec effondrement des facteurs de la coagulation (TP inférieur à 35-40 %), associées à une hémorragie active ou potentielle (acte invasif).
La stratégie thérapeutique dépend de la prédominance du syndrome hémorragique ou thrombotique, de l'étiologie de la CIVD et de la nécessité ou non d'un acte invasif.
Purpura thrombopénique thrombocytopénique (PTT)
Chez une partie des patients, le PTT est le premier signe évocateur de la pathologie maligne sous-jacente. Une étude récente a montré que 10 PTT sur 351 avaient une pathologie maligne sous jacente (Francis KK et al.2).
Il se définit comme un syndrome hémorragique lié à la diminution des plaquettes (souvent inférieures à 50 000/mm3) et à la dissémination de thrombi microvasculaires, conséquence d'une agrégation entre plaquettes et facteurs de Willebrandt.
Le PTT est évoqué devant une coagulopathie de consommation (schizocytes ou fragments d'érythrocytes au frottis) associé à une augmentation des LDH et de la créatinine plasmatique, et à des anomalies minimes du TP, du fibrinogène et des D Dimères normaux.
Chez les patients cancéreux, le purpura thrombocytopénique est essentiellement d'origine acquis. Il est par ailleurs souvent associé à une aplasie médullaire.
Le traitement du PTT chez le cancéreux est semblable à celui du patient non cancéreux.
Plusieurs études ont montré l'avantage d'échanges de plasma ou de plasmaphérèse chez les patients ayant un PTT dans le cadre d'un cancer, même lorsque la maladie sous jacente n'est pas contrôlée (Caramello V. et al.3 ; Werner TL et al.4). Le traitement repose sur l'administration de fortes doses de plasma, nécessitant le plus souvent un recours à des échanges plasmatiques. Les corticoïdes sont fréquemment utilisés en association au traitement par plasma, bien qu'aucune étude n'ait clairement montré la supériorité de cette association par rapport au traitement par plasma seul. Dans tous les cas, le facteur déclenchant du PTT devra être pris en charge.
Purpura thrombopénique idiopathique (PTI)
La thrombopénie chez les patients atteints de cancer peut être due au développement d'autoanticorps anti-plaquettes.
Ces mécanismes auto-immuns de thrombopénie sont davantage rencontrés chez les patients présentant des pathologies malignes hématologiques que chez les patients avec des tumeurs solides.
Des PTI ont cependant été retrouvés dans les cas de cancer du sein et de l'ovaire. (Porrata LF et al.5) Le PTI doit être soupçonné devant un frottis sanguin ne présentant aucune anomalie morphologique de la lignée rouge.
Faire la distinction entre CIVD et PTI ainsi que les autres étiologies de thrombopénie est important car les thérapeutiques sont très différentes. Toutefois, cette distinction peut poser quelques difficultés.
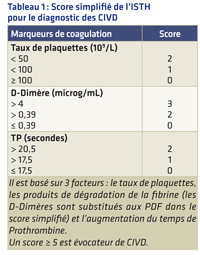
Pour la faciliter, un score a été développé par l'International Society on Thrombosis and Hemostasis (ISTH) (Taylor FB et al.6). Ce score est adapté aux patients ayant une pathologie maligne (Tableau 1).
Causes iatrogènes
Thrombopénies induites par l'héparine (Ancien TIH de type II, auto immune)
Il est clairement établi que l'incidence des complications veineuses thromboemboliques est supérieure chez les patients atteints de cancer par rapport à la population générale. Cette augmentation d'incidence est plurifactorielle. L'état d'hypercoagulabilité induit par les cellules cancéreuses est un élément cardinal. La présence d'un cathéter central et l'administration de chimiothérapie majorent ce risque.
La TIH est surtout observée avec l'utilisation des Héparine Non Fractionnée.
Elle survient généralement dans les 5-15 jours suivant l'introduction de l'héparinothérapie. Le taux de plaquettes diminue généralement à plus de 50 % par rapport aux analyses préthérapeutiques. Elle est liée à la présence d'anticorps circulants qui forment des complexes avec les facteurs plaquettaires (FP4) et l'héparine. Il en résulte une activation des plaquettes, qui adhèrent aux vaisseaux et entraînent la formation de thrombus.
La TIH peut entraîner une thrombose artérielle ou veineuse, il est donc important de l'identifier rapidement et d'introduire un traitement spécifique. Au frottis sanguin, bien qu'il puisse exister des schizocytes, leur présence est nettement moins fréquente que dans la CIVD ou le PTT.
Le temps de prothrombine et le TCK ne seront généralement pas modifiés. De même, le fibrinogène n'est pas autant diminué qu'en cas de CIVD. Les tests les plus utilisés pour le diagnostic de TIH sont le test d'activation plaquettaire en présence d'héparine et les études immunologiques permettant de détecter des anticorps anti-plaquettaire PF4 dans le sérum.
Cependant, chez les patients pour qui la suspicion clinique de TIH est élevée, les résultats de ces tests ne doivent pas retarder le traitement et l'héparinothérapie doit être cessée immédiatement et contre-indiquée. Par la suite, l'anticoagulation devra être assurée par un inhibiteur de thrombine direct comme la lepuridin, l'argatroban ou la bivalirudin (Baldwin ZK et al.7).
S'il n'existe pas de thrombose cliniquement évidente, on continuera le traitement par les inhibiteurs de thrombine direct jusqu'à normalisation de la numération plaquettaire puis 2 à 4 semaines supplémentaires.
Par ailleurs, chez les patients avec TIH et thrombose documentée, une anticoagulation à base de Warfarin doit être débutée dès que la numération plaquettaire est > 150 000/mL et doit être continuée durant 3-6 mois.
Faire la distinction entre coagulation intravasculaire disséminée et purpura thrombopénique idiopathique ainsi que les autres étiologies de thrombopénie est important car les thérapeutiques sont très différentes. Toutefois, cette distinction peut poser quelques difficultés. Pour la faciliter, un score a été développé par l'International Society on Thrombosis and Hemostasis (ISTH).
Thrombopénies médicamenteuses - Les thrombopénies sont les plus fréquentes des cytopénies immunes liées à la prise de médicaments et à leurs interactions avec les chimiothérapies.
Quatre mécanismes principaux sont impliqués :
formation d'anticorps anti-médicament qui se fixent sur les plaquettes en présence de la drogue soluble (quinine), anticorps dirigés contre la partie murine d'un anticorps chimérique (Ac anti-GpIIb/IIIa), formation de néo-antigènes (inhibiteurs de la GpIIb/IIIa), et autoanticorps se fixant sur les plaquettes en l'absence du médicament (sels d'or). La thrombopénie survient sept à dix jours après le début du traitement inducteur, ou plus tôt en cas de réintroduction ou d'administration d'anticorps anti-GpIIb/IIIa.
Le malade guérit en deux à cinq jours après l'arrêt du traitement en l'absence de complication. Tout médicament doit être suspecté devant un tableau compatible, mais les médicaments les plus fréquemment en cause sont la quinine, les anticorps anti-GpIIb/IIIa, les sels d'or, les sulfamides, la vancomycine, les thiazidiques, les sels de platine, et certains anti-inflammatoires L'évolution est habituellement favorable en quelques jours après arrêt du médicament responsable, qui devra être définitivement contreindiqué.
Thrombopénies infectieuses
Il est aussi important de considérer la possibilité d'une infection sous jacente chez les patients cancéreux présentant une thrombopénie.
En effet, ceux-ci peuvent être immunodéprimés par les traitements ou par la pathologie ellemême. L'infection par un agent viral (CMV, VIH, MNI, VHB, VHC) ou bactérien (E.Coli, Shigelle), de même qu'une réactivation virale peuvent alors être responsables d'une thrombopénie par production d'auto anticorps anti plaquettaires souvent transitoires.
Il s'agit d'un diagnostic différentiel important à prendre en considération, puisque le traitement de l'infection sous-jacente entraîne une amélioration spontanée de la thrombopénie.
Références
1. Sallah S, Wan JY, Nguyen MP, et al. Disseminated intravascular coagulation in solid tumors: clinical and pathological study. Thromb Haemost 2001 ;86:828-33.2. Francis KK, Kalyanam N, Terrell DR, et al. Disseminated malignancy misdiagnosed as thrombotic thrombocytopenic purpura: a report of 10 patients and a systematic review of published cases. Oncologist 2007 ;12:11-19.3. Caramello V, Dovio A, Caraci P, et al. Thrombotic thrombocytopenic purpura in advanced prostate cancer: case report and published work review. Int J Urology 2007 ;14:1502.4. Werner TL, Agarwal N, Carney HM, Rodgers GM. Management of cancer associated thrombotic microangiopathy : what is the right approach. Am J Heatol 2007 ;82:295-8.5. Porrata LF, Alberts S, Hook C, Hanson CA. Idiopathic thrombocytopenic purpura associated with breast cancer : a case report and review of the current literature. Am J Clin Oncol 1999 ;22:411-3.6. Taylor FB, Toh CH, Hoots WK, et al. Towards definition, clinical and laboratory criteria, and a scoring system for disseminated inravascular coagulation. Thromb Haemost 2001 ;86:1327-30.7. Baldwin ZK, Spitzer AL, Ng VL, Harken AH. Contemporary standards for the diagnosis and treatment of heparin induced thrombocytopenia. Surgery 2008 ;143:305-12.